免疫疗法是当下肿瘤治疗领域最具前景的发展方向之一。随着PD-(L)1等免疫检查点抑制剂应用范围逐渐扩大,CAR-T疗法研究不断出现新的进展,CAR-T疗法作为有别于传统药物的“活药”,不仅对复发、难治性肿瘤患者表现出了突破性疗效,其生产体系和使用场景也有别于普通药物。鉴于当下生物技术的更新速度,预计CAR-T疗法还将带给市场更多惊喜。
本报告拟从CAR-T疗法技术基础入手,分析CAR-T疗法的局限性及研发方向、行业发展情况、研发情况与如何选择国内标的、投融资情况及行业总结。
行业发展历程
CAR-T技术发展、演变至今,已有数十年历史。但从美国ClinicalTrials.gov网站登记的临床研究项目数量来看,CAR-T疗法真正迎来快速发展期是在2015年之后。从2015年到2017年,全球以及中国开展的CAR-T临床研究项目数量均大幅增长。而CAR-T产业化进程,则直到2017年FDA批准两款CAR-T产品上市,才逐渐加速。
当前,绝大多数公司的CAR-T产品都还未开展经注册的药物临床试验,CAR-T疗法行业正处于技术导入期,国内CAR-T产业化进程刚刚开始。
已上市CAR-T产品
2017年,FDA批准了两个CAR-T产品上市,开创了CAR-T疗法新纪元。
2017年8月31日,诺华的CAR-T疗法Kymriah(Tisagenlecleucel,CTL019)经美国FDA批准上市,用于治疗3-25岁的儿童和年轻成人急性淋巴细胞白血病(ALL)患者。Kymriah是全球首个获批的CAR-T治疗产品,揭开了恶性血液肿瘤免疫治疗的新篇章,具有里程碑式的意义。2018年5月1日,Kymriah获批第二个适应症,用于治疗复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)的成人患者(先前接受过两次或以上的系统治疗)。
2017年10月18日,Kite Pharma的CAR-T产品Yescarta (axicabtagene ciloleucel,KTE-C19)经美国FDA批准上市,用于治疗成人复发或难治性大B细胞淋巴瘤。Yescarta是全球第二款获批上市的CAR-T产品,同时也是第一个用于治疗非霍奇金淋巴瘤的CAR-T产品。
由于Kymriah和Yescarta的受试者中有部分出现了严重的细胞因子释放综合症(CRS)以及神经毒性,因此两个产品的药品标签中均带有CRS和神经毒性的黑框警告。FDA为两个产品设立了风险评估和减轻策略(REMS),用于提示和教育医护人员细胞治疗产品的副作用。两家公司均已逐渐掌握对副反应做出早期识别,并及时给予抗体或类固醇药物急救的应对策略,并要求所有使用产品的中心必须掌握REMS。同时,两家公司也将通过继续研究以找到应对副作用的更优方案。
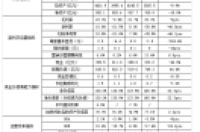
表1 已上市CAR-T产品的比较
资料来源:诺华官网、Kite Pharma官网、长城证券研究所
CAR-T行业市场空间
据市场调查数据显示,截至2018年,全球CAR-T细胞治疗市场估值已达一亿六千七百万美元。据Coherent Market Insights预测,在2018-2028年期间,全球CAR-T细胞治疗市场价值将以高达46.1%的平均年复合增长率增长。在未来一段时间内,北美仍将占据全球CAR-T细胞治疗50%以上的市场份额,欧洲市场居于次席。但随着中国CAR-T相关政策的推进以及研发力度的增强,越来越多的企业涌入CAR-T行业市场,中国有望在未来短时间内弯道超车,占据很大一部分全球市场份额。
图1 北美CAR-T市值预测(百万美元)和年复合增长率(Y-o-Y,2018-2028)
资料来源: Coherent Market insights (2018)
根据Nature Reviews杂志预测,2026年全球恶性血液肿瘤的市场规模将超过200亿美元,其中CAR-T市场约11亿美元。目前已获批的两个适应症(儿童及年轻成人急性淋巴细胞性白血病和弥漫性大B细胞淋巴瘤),预计将被CAR-T疗法占据最主要的市场份额,分别达44%和46%,超过生物制剂和小分子药物。在其他血液肿瘤领域,如慢性淋巴细胞性白血病、滤泡性淋巴瘤、套细胞瘤、多发性骨髓瘤,CAR-T也将占据少量市场份额。
长城证券就CAR-T目前仅获批的2个适应症保守测算了其在中国的市场空间。价格方面,保守预计国产CAR-T治疗费用可降至50万元人民币,其治疗儿童急性淋巴细胞白血病和漫性大B细胞淋巴瘤的潜在市场空间分别约为16亿元和73亿元。
表2 CAR-T就获批适应症市场空间测算
资料来源:流行病学统计资料、长城证券研究所
当然,CAR-T的市场空间远不止保守测算的数十亿元人民币,未来想象空间的拓展主要有以下3方面:
拓展适应症—其他血液肿瘤
除了目前已获批的2个适应症,CAR-T治疗其他血液肿瘤的临床试验也正在广泛开展中,并有望于1-3年内陆续获批,包括滤泡性淋巴瘤、原发纵隔大B细胞淋巴瘤、TFL-转化型滤泡性淋巴瘤、慢性淋巴细胞性白血病、多发性骨髓瘤等,市场空间可突破百亿。
拓展适应症—实体瘤
虽然目前CAR-T在实体瘤治疗方面进展缓慢,但未来随着更多靶点的发现以及临床试验的开展,实体瘤有望成为CAR-T的主要治疗领域。中国四种最常见肿瘤分别为肺癌、胃癌、肝癌和食管癌,四种癌症占全国肿瘤发病率的57%,考虑到实体瘤较血液肿瘤有更高的发病率,CAR-T治疗各种实体肿瘤的市场可达到血液瘤的5-10倍。
医保支付
美国国家医保机构Medicare于近日确定了2个CAR-T产品的门诊报销方案,特定患者自费比例降低80%,是CAR-T推广的重大利好。在我国鼓励药品创新的战略规划下,临床必须的治疗性产品将享受优先审评审批等各种优惠政策,特别是医保谈判和医保目录动态调整机制,可有效的改善临床用药结构,推动我国药品质量升级。未来CAR-T作为新上市的优秀治疗用药,大概率被纳入医保支付范围,将惠及到更多的肿瘤患者,市场空间巨大。
CAR-T行业的国内政策环境
随着CAR-T在国际上的快速发展,我国细胞免疫疗法也大致经历了宽松放开(第一阶段)、“魏则西”事件后的短暂停滞(第二阶段)以及现在的大浪淘沙、行业洗牌(第三阶段)。行业有望向有序、规范、健康的方向稳步前进。
第一阶段
全面放开、秩序混乱(2016年以前)
由于CAR-T疗法的特殊性,2009年卫生部将免疫细胞治疗技术纳入可进入临床研究和应用的第三类医疗技术管理。由于监管体制相对宽松,部分医疗机构科室在没有经过卫计委批准的情况下,纷纷开展免疫细胞治疗项目,各种形式的临床试验和临床应用项目迅速增加。
第二阶段
紧急叫停、举步维艰(2016年)
2016年4月,“魏则西”事件经过媒体宣传持续发酵,在社会上造成巨大影响,免疫细胞治疗技术的滥用引起了监管部门高度重视。5月,卫计委召开关于规范医疗机构科室管理和医疗技术管理工作的电视电话会议,明确要求所有类型的免疫细胞治疗技术停止应用于临床治疗,仅限于临床研究。包括CAR-T在内的免疫细胞治疗在国内进入停滞期。
第三阶段
有序放开、步入正轨(2017年至今)
2017 年12 月,《细胞治疗产品研究与评价技术指导原则(试行)》发布,提出了细胞治疗产品从早期研发到生产、从药学研究、非临床研究,到临床研究阶段应遵循的一般原则和基本要求,初步规范了细胞治疗产品的研究、开发与评价方法,未来仍将逐步完善、细化与修订。指导原则框架和内容科学合理,符合细胞治疗产品作为药品研发的规律,这是行业的大洗牌,促使产业门槛和监管力度的提高,一方面让缺乏核心技术、不符合水准的企业自行淘汰,另一方面鼓励合格研发机构的细胞治疗产品申报,进一步推动我国细胞治疗药品产业的发展和壮大。
表3 与免疫细胞治疗相关的政策文件
资料来源:国家卫计委、CFDA
按照一般药品审批流程,CAR-T疗法需经过临床试验申报等系列流程,才可获得上市机会。但目前CAR-T疗法的监管、审批规则不乏灵活之处。一方面,企业可在正式开展临床试验前先与医院合作,由医院发起非注册的早期临床研究,这有利于企业前期判断研发风险,避免盲目开展临床试验;另一方面,CAR-T治疗临床试验分期设计更灵活,所涉及样本量也较少,目前看来多在100例左右。
CAR-T产业链构成及特点
CAR-T疗法产业链中,上游为流式细胞仪等设备生产商和用于T细胞分选、转染等步骤的试剂,以及细胞因子等原、辅料。中、下游分别为CAR-T疗法的研发和产品生产。其中许多研发企业也选择自行制备慢病毒载体,生产CAR-T细胞。
(一) 产业链——上、中、下游
1. 关键设备、试剂、原料多来自跨国企业,价格较高
CAR-T细胞制备涉及T细胞分离、激活等步骤,需用到血细胞分离淘洗机等多种设备、试剂及耗材。这些关键设备及试剂供应商多来自跨国公司,如GE、德国美天旎、赛默飞世尔等。国内也有相应设备、试剂生产商,其价格有些仅为进口产品的1/10,但在产品质量方面相对落后。因此国内研发企业大多选择采购进口产品,这构成了CAR-T细胞生产过程中近一半成本。
如果把CAR-T治疗视为一种产品,病毒载体则可视为关键原料,其制备过程及质量控制需要大量资金投入。目前全球仅有OxfordBioMedica等几家企业,具有病毒载体制备的核心技术和稳定的规模化生产工艺,这意味着其价格也比较高。随着CAR-T等基因疗法技术的发展,病毒载体可能会出现供不应求的情况。
2. 产业分化度不高,第三方外包服务商参与空间有限
国内CMO等第三方医药外包服务商,因最近几年生物医药产业的发展而壮大。但在CAR-T疗法领域,目前第三方外包服务商的参与空间有限。一般第三方外包服务商分三类,包括委托合同研究组织(CRO)、委托合同生产组织(CMO)、委托合同销售组织(CSO),分别对应药品的研发、生产和销售服务。近年来,覆盖药品研发和生产服务的CDMO模式也逐渐兴起。
目前国内CRO在CAR-T疗法领域参与的服务内容包括安全性评价、临床数据管理等,CMO/CDMO的作用还未充分体现。一方面,CAR-T疗法是新生事物,国内缺乏具备相应服务能力的CMO/CDMO,包括质粒、病毒载体、CAR-T细胞制备等;另一方面,很多研发企业担心核心技术、制备工艺泄露。
(二)产业链——销售终端
应用门槛高于普通药品,医院、医生需具备相应治疗经验
作为一种新兴的细胞疗法,CAR-T治疗和普通抗肿瘤药物一样,最终都需经过医院、医生才会用于患者。但不同之处在于,CAR-T治疗对医院、医生有更高的要求。相应地,其未来应用场景和模式也会与传统药物有所差别。
CAR-T治疗过程涉及细胞提取、细胞回输、监控不良反应等步骤。如果患者在医院接受治疗,而由企业将CAR-T细胞运输到医院,则对医院环境、医生能力具有相应要求,从而确保治疗过程顺利进行,及时处理患者可能出现的不良反应。
未来CAR-T疗法在国内上市后,其落地模式可能有很多种。比如由企业与医院合作,在医院内部建立细胞治疗中心,这些医院很可能是企业在临床试验阶段的合作医院。或者企业自建细胞治疗中心,临床研究与临床应用并举,但这也需要具备相应治疗经验的医院支持。
来源:火石创造