KRAS是实体瘤中最常见的致癌蛋白,一度被认为是“不可成药”靶点。近两年来,一些抑制剂已证明对KRAS G12C突变患者有效,并已改变了目前的临床实践。本文梳理了癌细胞和肿瘤微环境中的RAS 信号通路特征,并整理了针对致癌RAS的治疗策略及未来的研究方向。
RAS通路
RAS信号传导在正常细胞增殖中发挥重要作用,在肿瘤发生过程中该信号通路通常发生异常。事实上,该信号通路相关成分的改变,尤其是RAS蛋白本身的改变,对肿瘤细胞具有深远影响。因此,在过去的几十年里,研究者在靶向“RAS蛋白”——RAS–RAF–MEK–ERK通路的中心成员——药物方面做出了巨大努力。2021年,几十年的研究终于取得了成功。
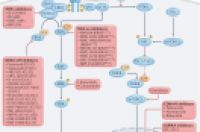
RAS–RAF–MEK–ERK 丝裂原活化激酶(MAPK) 信号通路可被大多数生长因子、细胞因子和免疫受体以及许多整合素和趋化因子受体激活。RAS家族GTP激酶包括KRAS、NRAS 和 HRAS,在加载GTP的“开启”和加载GDP的 “关闭”状态之间循环。在激活-失活过程中,RAS蛋白中的两个区域(称为“开关 1”和“开关 2”结构域)的构象发生改变,“开关 2” 被证明对 RAS 抑制剂最终开发成功至关重要。
目前,已开发出多种抑制剂可直接靶向突变 RAS 蛋白,包括结合非活性、GDP状态(“KRAS-off 抑制剂”)和结合活性、GTP状态(“KRAS-on 抑制剂”)的抑制剂。目前,正在临床试验中进行评估。RAS信号通路有许多上游和下游介质,有望与RAS抑制剂联合以提高抗肿瘤反应并减少内在和获得性耐药,是很有吸引力的靶标。
图1 RAS信号通路及癌症中靶向该通路的疗法
癌症中的RAS突变
RAS通路蛋白异常包括RAS突变的激活,在多种恶性肿瘤中很常见。RAS基因突变在胃肠肿瘤和肺癌中很常见,大部分突变是KRAS突变。
影响RAS-RAF-MEK-ERK信号通路突变的因素包括RTKs、SHP2、NF1、RAS 蛋白、RAF家族成员或 MEK1/MEK2,可导致该通路的异常激活和肿瘤发生。RAS突变或扩增是人类癌症中最常见的异常之一,KRAS最常发生异常,尤其在实体瘤中;NRAS突变常发生于黑色素瘤和血液系统恶性肿瘤;HRAS突变主要见于膀胱癌、甲状腺癌、宫颈癌和头颈癌。
图2 不同瘤种中KRAS、NRAS和HRAS突变的发生率
总体上,约17%的实体瘤存在KRAS突变,包括约90%的胰腺癌、约50%的结肠癌和约25%的肺腺癌。KRAS突变在NSCLC中占主导地位,约占此类肿瘤中所有RAS突变的78%。且通常与其他临床上可靶向驱动突变互斥,例如EGFR、BRAF和ALK。
不同KRAS突变对NSCLC具有不同的预后或预测意义。BATTLE研究显示,在既往接受分子靶向治疗的难治性NSCLC患者中,与野生型或其他KRAS突变类型相比,KRAS G12C或KRAS G12V突变患者的PFS更差相关。另有研究显示,与非G12C突变相比, KRAS G12C突变患者的PFS有所改善。目前的研究提示,需进一步研究以阐明不同KRAS突变的预后和预测价值。
KRAS与肿瘤抑制基因STK11、TP53或CDKN2A/CDKN2B共存突变经常见于KRAS突变肿瘤。KRAS-STK11共突变患者可细分为KEAP1野生型或KEAP1突变型。在无STK11突变情况下,KEAP1也可与KRAS突变共存出现。这两种突变模式都与治疗耐药性相关,并且可能导致免疫或联合治疗的反应更差或不良预后。
KRAS靶点成药的难点
KRAS蛋白是一种无特征、近乎球形的结构,无明显结合位点,很难合成一种能靶向结合并抑制其活性的化合物质。
几十年来,与KRAS的“斗争”反映了三个关键生化特征带来的挑战:首先,与其他蛋白激酶与ATP的亲和力较弱不同,RAS蛋白对GTP的亲和力非常强,达到皮摩尔浓度级别;第二,细胞内高浓度的 GTP(~500 nM) ,比与KRAS结合所需的浓度高10 6 倍。第三,RAS蛋白缺乏“足够深”或药理学上可用的小分子结合“口袋”。克服RAS对GTP的皮摩尔级亲和力将需要具有前所未有结合特性的小分子。而KRAS蛋白的GTP 结合位点在特定KRAS突变体又有所不同,这进一步使得KRAS抑制剂的设计更复杂化。
所有第一代KRAS抑制剂均与非活性、GDP结合的KRAS结合(KRAS-off 抑制剂)。最近,研究者也已开发出靶向活性 KRAS-GTP的“KRAS-on”抑制剂,例如 RM-018(图 1和表 1)。
表1 经筛选的KRAS靶向疗法
临床上应用的KRAS G12C抑制剂
I/II 期CodeBreaK 100 研究——纳入22例患者并接受 sotorasib 的晚期KRAS G12C突变实体瘤患者的初步人体试验数据显示出单药的抗肿瘤活性。纳入129例的I期研究显示,59例晚期NSCLC患者的客观缓解率(ORR) 为 32.2%,疾病控制率(DCR) 为 88.1%,中位无进展生存期(PFS)为6.3个月。II期CodeBreaK 100研究显示,124例可评估晚期KRAS G12C突变 NSCLC 患者的ORR为37.1%,中位缓解持续时间(DOR) 为 11.1 个月,中位 PFS为6.8个月和中位 OS 为12.5个月。这些令人印象深刻的结果致使FDA加速批准了sotorasib用于NSCLC的适应证。目前III 期CodeBreaK 200试验正在探索sotorasib对比多西他赛用于单药或联合治疗后进展的KRAS G12C突变患者的疗效。其他sotorasib的相关研究也正在探索中(表 1)。
Adagrasib是第二个进入临床试验的KRAS G12C抑制剂。基于I/II 期KRYSTAL-1研究数据,adagrasib获得FDA突破性疗法认定用于经治KRAS G12C突变晚期NSCLC患者。2021年ESMO大会上公布的数据显示,DCR为96%,51例可评估患者中有 23例(45%)达到部分缓解(PR),在KRYSTAL-1研究的I/Ib期部分,16例接受II期推荐剂量KRAS G12C患者的中位 PFS为11.1个月,中位 DOR为16.4 个月。KRYSTAL-1研究II期队列纳入116例患者既往经治NSCLC患者,更新ORR为42.9%,DCR为79.5%,中位 DOR为8.5个月,中位 PFS 为6.5个月,中位OS为12.6个月,预估1年OS率为50.8% 。此外,在既往接受过治疗的稳定脑转移亚组中(n = 33),颅内ORR为33.3% 。关于adagrasib的大量临床研究也正在进行中(表1)。
其他几种有类似作用机制的KRAS G12C抑制剂已进入临床开发阶段(表1)。研究者正在探索GDC-6036(也称为 RG6330)单药和联合其他激酶抑制剂以及 SHP2 抑制剂 GDC-1971用于晚期KRAS G12C突变实体瘤的疗效(NCT04449874)。JDQ443是一种共价不可逆 KRAS G12C-off抑制剂,目前也已进入临床试验。I/II 期KontRASt-01试验正在评估 JDQ443单药或联合TNO155(一种 SHP2抑制剂)和/或替雷利珠单抗用于KRAS G12C突变 NSCLC、结直肠癌或其他晚期实体患者肿瘤的疗效。LY3537982,一种选择性 KRAS G12C抑制剂,也处于I 期临床试验阶段。I/II 期试验中的其他 KRAS G12C抑制剂还包括 D-1553、JNJ-74699157、BI 1823911、JAB-21822 和 MK-1084。
KRAS G12C抑制剂的成功带来的巨大进步值得反复深究和学习。但是,KRAS G12C抑制剂单药的长期生存获益仍有限,目前,已有研究报道了相关的原发性和获得性耐药机制,可诱导免疫抑制状态的TME变化也可能与耐药性相关。
克服 KRAS G12C抑制剂耐药性
“垂直”组合策略
在 NSCLC 和结直肠癌中,KRAS G12C抑制剂可导致活化的上游 EGFR和/或其他ERBB家族成员的积累,这可能导致KRAS G12C抑制剂单药疗法的耐药。因此,KRAS G12C和EGFR的联合抑制目前正在进行相关的临床试验(图 1)。CodeBreaK 101研究正在探索sotorasib+EGFR/HER2 TKI阿法替尼或EGFR单抗(±FOLFIRI)联合使用的价值。KRYSTAL-1和KRYSTAL-10也正在探索adagrasib+另一种EGFR单克隆抗体西妥昔单抗的疗效。NCT04449874也正在探索GDC-6036+西妥昔单抗或厄洛替尼的有效性和安全性。
自1992年被发现以来,SHP2已成为RAS-MAPK信号通路的关键上游调控因子,是多种致癌驱动突变激酶信号传导的重要组成部分(图1)。临床前研究显示,抑制SHP2可能在KRAS突变NSCLC的治疗中发挥作重要作用。
基于临床前研究的良好结果,KRYSTAL-2、CodeBreak 101、KontRASt-01研究目前分别正在探索SHP2 抑制剂TNO155+adagrasib、联合sotorasib、联合JDQ443的疗效。CodeBreaK 101研究还在探索sotorasib与RMC-4360(一种类似于 RMC-4550的SHP2 抑制剂)联合的应用。
通过SOS1间接靶向RAS构成了该信号通路的另一种“垂直”抑制形式。SOS1及其旁系物 SOS2 是至关重要的RAS-GEF成员。SOS1/2抑制剂代表着抑制RAS突变体活性的另一种不同策略(图 1)。BI-3406是一种口服小分子抑制剂,可选择性地结合在 SOS1的活性位点内,并破坏其与RAS-GDP的相互作用。BI1701963 是一种与BI-3406类似的小分子。KRYSTAL-14研究正在探索单药及联合adagrasib 的疗效。
CodeBreaK 101 试验也在各种KRAS G12C突变实体瘤患者中评估曲美替尼联合sotorasib±帕尼单抗的疗效。这种联合策略的原理是由于RAF介导的MEK激活而使KRAS突变肿瘤细胞对MEK抑制剂具有原发性耐药的特性(图 1),这可通过同时抑制突变KRAS突变而消除这种耐药性。CodeBreak 101研究中sotorasib+曲美替尼的初步结果显示该联合方案是安全、可耐受的,重要的是,即使既往接受过KRAS G12C抑制剂多的患者也能从联合治疗中获益。
“水平”组合策略
图1 示mTOR抑制剂作为克服KRAS(或MEK)抑制剂获得性耐药的替代策略(图 1)。CodeBreak 101研究正在探索mTOR 抑制剂依维莫司+sotorasib的联合策略。
细胞周期抑制剂与KRAS抑制剂的协同作用或能提供了另一种潜在的组合策略(图 1)。CDK4/6 抑制剂可有效治疗某些癌症,尤其是雌激素受体阳性乳腺癌。CDK4/6抑制剂会阻滞D型细胞周期蛋白驱动的细胞周期进程——RAS-MAPK和PI3K-AKT通路汇聚的节点。CodeBreak 101也正在探索将sotorasib与palbociclib联合的治疗策略。
免疫介导的肿瘤逃逸和免疫联合策略
KRAS突变与其他驱动致癌基因一样,除了改变肿瘤细胞本身的行为(图 3)外,还对肿瘤微环境(TME)产生影响。
激活KRAS突变对肿瘤免疫微环境有许多影响包括巨噬细胞的激活和募集、M1到M2 巨噬细胞的极化等。肿瘤微环境的改变可为KRAS突变恶性肿瘤的治疗提供机会。
图3 突变 KRAS 对肿瘤免疫微环境的影响
KRAS具有多种免疫调节作用,可通过多种机制介导(图 3)。研究发现,KRAS致癌突变可通过促进免疫抑制性TME而促进免疫逃逸,这种抑制性可通过抑制SHP2来缓解——可能是潜在的联合策略。
目前,这种将 KRAS G12C抑制剂与免疫治疗的联合正在多项临床试验中进行探索,包括 CodeBreaK 100、CodeBreaK 101、KRYSTAL-1 和 KRYSTAL-7、GO421447、KontRASt-01。
此外,其他潜在的治疗策略也正在探索中,包括KRAS-on抑制剂的开发、RAS降解剂和毒素、靶向KRAS的免疫疗法、基于siRNA 的方法等。
结语
自三十多年前在肺癌中发现KRAS突变以来,KRAS靶向药物的发现已经取得了巨大进展,目前有大量抑制剂、联合策略和替代靶向疗法正在临床研究中。但是,关于KRAS G12C抑制剂的数据提示,这些药物远未达到“治愈”效果。部分原因是单药治疗容易出现耐药。
目前,研究者正通过“垂直”抑制RAS通路的多个节点来克服耐药。此外,治疗策略还包括同时抑制平行通路,联合免疫治疗策略。同时,研究者也在不断开发新策略靶向RAS,这些策略为KRAS靶向治疗带来了新希望,目前为止,KRAS已摆脱了“不可成药”靶点的称号。期待上述联合策略和新策略能在KRAS突变恶性肿瘤患者中实现长期“治愈”目标。
参考文献:
Punekar SR, Velcheti V, Neel BG, Wong KK. The current state of the art and future trends in RAS-targeted cancer therapies. Nat Rev Clin Oncol. 2022 Oct;19(10):637-655. doi: 10.1038/s41571-022-00671-9. Epub 2022 Aug 26. PMID: 36028717; PMCID: PMC9412785.




